I. Un exemple de maladie génétique : la mucoviscidose
• A. Le phénotype mucoviscidose
• B. Une défaillance de la protéine CFTR est à l'origine de la maladie
TP 1. La mucoviscidose
• C. L’étude d’un arbre généalogique permet de prévoir le risque de transmission de la maladie
• D. La lutte contre la mucoviscidose
• L'essentiel
TP 2. Information génétique et maladies humaines
II. Un exemple de maladie plurifactorielle : le diabète de type II
• A. Le phénotype diabète de type 2 représente 90 % des cas de diabète
• B. Épidémiologie du diabète
• L'essentiel
III. Perturbation du génome et cancérisation
• A. Le mécanisme de cancérisation
• B. Un cancer est une maladie multifactorielle
• L'essentiel
TP 3. La résistance des bactéries aux antibiotiques
IV. Variation génétique bactérienne et résistance aux antibiotiques
• A. Qu'est-ce qu'un antibiotique ?
• B. Origines des résistances aux antibiotiques
• C. L'utilisation excessive des antibiotiques pose un problème de santé publique
• L'essentiel
BILAN
● Les mutations provoquent des variations de l'information génétique des cellules somatiques et/ou des cellules germinales. Elles peuvent aussi affecter les microorganismes susceptibles de nous infecter (voir chapitre 1.2).
● L'expression d'un phénotype résulte souvent de la combinaison du génotype et de facteurs de l'environnement (voir chapitre 1.4).
● À partir de quatre exemples, on cherche à préciser les interactions entre la variation génétique et l'environnement de manière à dégager des méthodes de prévention face à la maladie.
Image : www.vaincrelamuco.org

Le mucus est une substance fluide qui tapisse et humidifie les canaux de certains organes de notre corps et protège leur surface. La mucoviscidose, se manifeste par un mucus épais et visqueux ce qui provoque notamment des difficultés digestives, conduisant à une malnutrition, et respiratoires car les poumons sont peu à peu dégradés provoquant une insuffisance respiratoire, principale cause de mortalité. Cependant, l'importance relative des divers phénotypes cliniques varie beaucoup selon les malades.
Image (modifiée) : sante.lefigaro.fr

Dans les cas de mucoviscidose les bronches sont obstruées par un mucus épais (A). L'image est à comparer avec une bronche normale (B). Les bronches sont en outre dilatées (C) et plus ou moins obstruées par les sécrétions (anneaux et taches blanches). L'image est à comparer avec un scanner normal (D).
Images : www.gnis-pedagogie.org Service de pédiatrie-pneumologie-allergologie de Lyon

Chez une personne atteinte de mucoviscidose, le mucus adhère aux parois des bronches :
- les bronches sont encombrées ce qui provoque toux et expectorations ;
- des agents infectieux (virus et surtout bactéries) sont retenus ce qui provoque des infections.
Image : www.inserm.fr

Les enzymes sont bloquées dans le pancréas ce qui empêche la digestion des aliments. Cela entraîne des douleurs abdominales, des diarrhées ou une constipation ainsi que des difficultés de prise de poids et des carences vitaminiques liées à une difficulté d'absorption des graisses et des vitamines liposolubles. Dans le foie les voies biliaires sont détruites ou obstruées. Les intestins peuvent également être obstrués.
Image : www.arcagy.org

Dans une cellule normale (A), la protéine CFTR (en vert) est localisée dans le cytoplasme, où elle elle est produite, et sur la membrane. Chez les personnes atteintes de mucoviscidose (B), la protéine CFTR n'est pas produite ou s'accumule dans le cytoplasme et n'apparaît plus sur la membrane. (Sur les deux images le noyau apparaît en bleu.)
Image : www.mucoviscidose-cftr.com
 2
2 
1. Position de la protéine CFTR - 2 Rôle de la protéine CFTR
La protéine CFTR est située sur la membrane apicale des cellules épithéliales de divers tissus. Elle forme un canal chlore, à travers la membrane plasmique (1), qui permet par ailleurs un transport d'eau (2A). Cela est nécessaire pour assurer la fluidité du mucus qui tapisse les cellules épithéliales. Dans une cellule malade (2B) la protéine CFTR n'est pas fonctionnelle. L’absence de sécrétion des ions chlorures provoque une augmentation de la réabsorption d’eau qui entraîne l’épaississement du mucus par déshydratation. Il ne peut plus être évacué au fur et à mesure de sa formation, n'assure plus sa fonction et s'accumule.
Remarque. Au niveau des glandes sudoripares, l'orientation des flux d'ions est inversée, ce qui explique la concentration élevée d'ions chlorures dans la sueur des malades (www.chups.jussieu.fr). Le principe du test de la sueur, utilisé pour diagnostiquer la maladie, repose sur cette particularité.
Image : 1 d'après www.librairiedemolecules.education.fr ; www2.ac-lyon.fr/enseigne/biologie - 2 www-dsv.cea.fr

Le gène CFTR est situé sur le chromosmome 7.
ATTENTION. Les bandes et les sous bandes d'un chromosome sont obtenues par coloration et ne correspondent pas chacune à un gène mais à plusieurs gènes (il y a beaucoup plus de gènes que de bandes).
Image (modifiée) ghr.nlm.nih.gov

Le gène CFTR est un gène de grande taille de 250 000 paires de bases (250 kb). Il possède 27 exons soit 4443 nucléotides qui codent les 1480 acides aminés que compte la protéine CFTR.
 2
2  3
3
1 Répartition et fréquence des mutations du gène CFTR - 2 Deux exemples de mutations du gène CFTR - 3 Localisation de la phénylalanine 508 sur la protéine CFTR
Plus de 1700 mutations du gène CFTR ont été identifiées (1), mais seulement 6 ont une fréquence supérieure à 1% des mutations observées (les autres sont donc rares et ne touchent souvent qu'une seule famille). La mutation de loin la plus fréquente est la délétion F508del (= ΔF508) dans l'exon 10 qui élimine le triplet 508 (2 voir la remarque dans 1s33tp1) désignant la phénylalanine (3) qui a pour conséquence une maturation anormale de la protéine CFTR qui ne parvient pas à la membrance apicale de la cellule. Elle représente à elle seule 70% des allèles mutés (jusquà à 90% selon les sources), et 50% des malades.
Images : 1 d'après www.carabin.fr et rms.medhyg.ch - 2 Traitement RasTop (modifié) à partir de données www2.ac-lyon.fr
F508del ou ΔF508 : del ou Δ signifient la perte d'un résidu (délétion) - F est le symbole de la phénylalanine dans le code à une lettre - 508 est la position du triplet du résidu muté.
R553X : R (arginine dans le code à une lettre) est le résidu dont le triplet est muté - 553 est la position du triplet du résidu muté - X apparition d'un codon stop (mutation non-sens).
G551D : signifie la substitution d'un codon G (glycine dans le code à une lettre) par un codon D (acide aspartique dans le code à une lettre) en position 551.
Sources : college-genetique.igh.cnrs.fr - atlasgeneticsoncology.org

" La prévalence (de la mucoviscidose) en France est de l'ordre de 1/5000 naissances avec d'importantes différence régionales. Ainsi, en Bretagne la prévalence est de 1/2000. En région parisienne et dans le sud de la France, elle est de l'ordre de 1/10 000" *. Pour simplifier les calculs on retiendra ici une prévalence de 1/4 900 naissances.
*Source : www.ccne-ethique.fr avis n° 83 du 18-12-2003 p. 2
 2
2
1 Caryotypes humains - 2 Garniture allélique d'un chromosome
Chaque cellule contient 23 paires de chromosomes (1) formées chacune d'un chromosome maternel et d'un chromosome paternel. Les chromosomes d'une même paire contiennent les mêmes gènes (sauf, en partie, les chromosomes sexuels XY) mais pas forcément les mêmes allèles (2). Bien qu'un gène puisse avoir de nombreux allèles, chaque individu ne porte donc que deux allèles par gène. S'ils sont identiques, il est dit homozygote, s'ils sont différents, il est dit hétérozygote. Un phénotype est dominant si un seul allèle est suffisant pour l'induire et récessif si deux allèles sont nécessaires. Un gamète (= cellule reproductrice) ne contient qu'un seul chromosome par paire et donc un seul allèle par gène. Remarquer qu'un gamète n'exprime pas le phénotype.
Image 1: jeanvilarsciences.free.fr
 2
2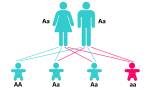
1 Transmission des allèles de la mucoviscidose - 2 La mucovisvidose est une maladie récessive
Soit A l'allèle sain (CFTR-CDS dans1) et a un allèle muté défaillant (deltaF508 ou R553X dans 1). Pour qu'un individu soit malade il doit posséder un allèle a transmis par un parent non malade qui possède donc aussi l'allèle A. Le parent est donc hétérozygote Aa (1) et le phénotype sain est dominant, on le note [A]. Le phénotype mucoviscidose est alors récessif (2), on le note [a] et il correspond au génotype homozygote aa (fils 1 dans 1).
Pour que deux parents non malades aient un enfant malade ils doivent doivent transmettre chacun un allèle a à leur enfant tout en possédant l'allèle A, ils sont donc tous les deux hétérozygotes Aa.
Remarque. Les porteurs hétérozygotes de la mutation deltaF508 sont asymptomatiques avec seulement 50% d'expression normale CFTR.
Source : college-genetique.igh.cnrs.fr

Chaque parent produit deux types de gamètes a et A de manière équiprobable. Un échiquier de croisement permet de déterminer les combinaisons possibles de ces gamètes.
Probabilité d'avoir un enfant non malade [A] AA ou Aa = 3/4 dont :
- non malade [A] hétézygote Aa = 2/3
- non malade [A] homozygote Aa = 1/3

Soit p la fréquence de l'allèle A et q la fréquence de l'allèle a ; p et q étant inconnus. Dans la population générale, les unions se faisant au hasard, il y a un mélange aléatoire de gamètes porteurs de l’allèle A ou de l’allèle a et un échiquier de croisement permet de déterminer les combinaisons possibles de ces gamètes.
Or, si on ne considère que deux allèles, p + q = 1 donc p = 1 - q soit 1 - 1/70 c'est à dire environ 1.
Fréquence des hétérozygotes = 2 pq soit 2 x 1 x 1/70 = 1/35
Un Français sur 35 est donc porteur de l'allèle muté a sans être malade.
Exercice 1

Trois naissances sont attendues dans cette famille (III2, III4 et III5). L'enfant III1 étant atteint de mucoviscidose les couples II1-II2, II6-II7 et II4-II5 souhaitent connaître leur risque d'avoir un enfant malade.
Calculer ce risque pour les trois couples pris dans cet ordre et sachant qu'avant leur union les couples de la génération I ainsi que les individus II1 et II7 ne connaissaient pas de cas de mucoviscidose dans leur famille.
Correction
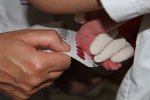
Un dépistage néonatal systématique de la mucoviscidose a été mis en place en 2002 en France. Il est réalisé trois jours après la naissance de l'enfant à partir d'une goutte de sang séchée en même temps que le dépistage d'autes maladies dont la phénylcétonurie, qui est aussi une maladie génétique. En effet plus la prise en charge (nutritionnelle essentiellement) est précoce, meilleur est le pronostic.
Image : www.jim.fr

En cas de signes cliniques suspects, le test de la sueur est réalisable à tout âge à partir de 5 semaines. Il consiste à stimuler les glandes sudoripares, au niveau de la face interne du bras, au-dessus du pli du coude, en utilisant un faible courant électrique. Le test est positif si la concentration de chlore dans la sueur recueillie est supérieure a 60 mmol/L (voir § I.B).
Image : www.hopkinscf.org
- de test positif, à partir d’un prélèvement de sang veineux ;
- d'échographie fœtale révélant une obstruction intestinale, à partir de villosités choriales (diagnostic prénatal) ;
- de risque génétique particulièrement élevé, à partir de cellules embryonnaires lors d'une FIV (diagnostic préimplantatoire).
Le diagnostic moléculaire de la mucoviscidose est rendu difficile par la taille importante du gène et le nombre important de mutations. On travaille donc par exemple sur des fragments d'exons susceptibles de renfermer une mutation.

La mutation F508del étant la plus fréquente, celle-ci peut être recherchée en première intention. Des fragments d'exon 10 de 50 paires de bases (50 pb) sont coupés de part et d'autre du triplet 508. En cas de mutation F508del ce fragment ne fait plus que 47 pb, car il y a délétion de trois nucléotides. Les fragments sont alors séparés en fonction de leur taille par électrophorèse.
Pour rechercher une substitution, comme dans la mutation G542X où GGA devient TGA, on peut employer des sondes moléculaires complémentaires et spécifiques l’une de l’allèle normal et l’autre de l’allèle muté avec lesquelles elles pourront s'hybrider. Les sondes sont marquées avec un traceur radioactif, ce qui permet de les identifier par autoradiographie après électrophorèse.
Source et images (modifiées) : www.sesep.uvsq.fr

Pratiquée quotidiennement, la kinésithérapie respiratoire permet d'évacuer les sécrétions bronchiques ce qui apporte un effet bénéfique immédiat. Elle rééduque aussi la toux pour qu'elle devienne plus efficace. La pratique d’une activité sportive régulière et adaptée aux capacités respiratoires est recommandée.

Des mucolytiques (expectorants ou fluidifiants bronchiques) rendent le mucus moins visqueux et facilitent son évacuation. Les bronchiodilatateurs facilitent la ventilation pulmonaire. L'utilisation d'antibiotiques et de corticoïdes permet de lutter contre les infections et surinfections. Au stade de l'insuffisance respiratoire chronique l'air est enrichi en dioxygène (oxygénothérapie). Lorsqu'il y a atteinte sévère des voies respiratoires, la greffe de poumon (voire cœur/poumon) permet de restaurer une fonction respiratoire correcte mais elle ne permet pas de guérir la maladie.
Image : baladaho.blogspot.fr - Patrice Allard - Association Vaincre la Mucoviscidose

Pour compenser les troubles digestifs, les apports alimentaires énergétiques doivent être légèrement supérieurs aux apports journaliers recommandés (généralement 100 à 110 % des AJR). De plus, des extraits pancréatiques ainsi que des apports en vitamines A, D, E (liposolubles) et souvent des oligo-éléments sont également nécessaires (la greffe de foie est rarement envisagée). Les besoins en eau et en sodium sont majorés car la sudation est importante.
Images : www.newpharma.be & pancreaticcanceraction.org

La mucoviscidose est une maladie monogénique, c'est à dire causée par la défaillance d'un seul gène. La thérapie génique somatique consiste à introduire, grâce à un vecteur, le gène CFTR fonctionnel dans des cellules de l'épithélium des voies respiratoires dans le but de corriger les manifestations respiratoires de la mucoviscidose.
Le vecteur transporte (1) le gène CFTR fonctionnel jusqu'à la cellule cible (2) dans laquelle le gène est transféré (3) et contenant le gène défaillant (4). Le gène fonctionnel migre alors vers le noyau (5) puis il et traduit en protéine CFTR (6). Cette dernière est enfin transportée jusqu'à la membrane plasmique (7) où elle fonctionne comme un canal chlore.

On peut envisager d'utiliser de l'ADN nu mais on améliore la pénétration du gène dans les cellules en le plaçant dans un vecteur capable de pénétrer à l'intérieur des cellules du patient. Il peut s'agir soit d'un virus non pathogène dont on supprimé l'information génétique virale, soit d'un liposome.
Images : adénovirus www.slimfils.com - liposome www.supplementclinic.com

On peut soit directement injecter le matériel génétique fonctionnel (voie in vivo) soit le multiplier d'abord en laboratoire dans des cellules de l'organisme (voie ex vivo). Dans le cas de la mucoviscidose, la voie in vivo est privilégiée car il est difficile de manipuler l'épithélium pulmonaire ex vivo. On utilise un vecteur directement administré dans les voies aériennes des patients par aérosol, on parle alors d’injection in situ.
Image (modifiée) : www2.cnrs.fr - A. Dagan d'après Catherine Caillaud
● La mucoviscidose est la maladie génétique la plus fréquente dans les populations européennes. Son phénotype cellulaire se manifeste par la production d'un mucus épais et visqueux qui s'accumule à la surface des cellules épithéliales. À l'échelle macroscopique, cela provoque notamment de graves difficultés digestives (conduisant à une malnutrition), respiratoires (car les poumons sont peu à peu dégradés) et à des infections.
● À l'échelle moléculaire, la maladie est due à une défaillance de la protéine CFTR qui est un canal ionique permettant d'assurer le fluidité du mucus.
 Rôle de la protéine CFTR
Rôle de la protéine CFTR
La protéine CFTR est codée par un gène (porté par le chromosome 7) qui a subi diverses mutations dont la plus fréquente (F508del) ne permet pas la maturation normale de la protéine qui ne parvient plus à la surface de la cellule.
● La mucoviscidose est une maladie génétique monogénique. Dans la population générale une personne sur 35 environ est porteuse d'un allèle défaillant mais seules sont malades les personnes qui en possèdent deux, soit une naissance sur 5000 environ.
● La mucoviscidose a un phénotype récessif. Pour qu'un enfant soit malade, il faut que ses deux parents soient hétérozygotes (porteurs chacun d'un allèle sauvage et d'un allèle défaillant). Dans ce cas, la probabilité de transmission de la maladie est de 1/4 et les enfants non malades ont une probabilité de 2/3, au lieu de 1/35, d'être eux mêmes hétérozygotes. L'hétérozygotie dépend donc du contexte familial et l'arbre généalogique permet de prévoir le risque de transmission de la maladie.
 Probabilité pour un couple d'hétérozygotes d'avoir un enfant malade
Probabilité pour un couple d'hétérozygotes d'avoir un enfant malade
● Actuellement, on limite les effets de la maladie en agissant sur les paramètres du milieu (kinésithérapie respiratoire, médicaments, alimentation...). Ces traitements sont d'autant plus efficaces qu'ils sont appliqués jeune, ce qui nécessite un dépistage précoce de la maladie. Ils ont permis d'améliorer l'espérance de vie des patients (qui est passée de 7 ans en 1965 à 47 ans en 2005). La thérapie génique constitue le seul espoir de correction de la maladie dans les cellules pulmonaires atteintes. Elle consiste à introduire, grâce à un vecteur, le gène CFTR fonctionnel dans des cellules de l'épithélium des voies respiratoires. À ce jour, aucune stratégie de thérapie génique n'a encore permis de transférer le gène fonctionnel de manière permanente.
 2
2  3
3  4
4 
1 Molécule de glucose - 2 Évolution de la glycémie sur 24 heures chez un sujet en bonne santé - 3 Glycémie et insulinémie à la suite d'un repas riche en glucides - 4 Mesure de la glycémie
Le glucose (1) est le principal métabolite énergétique de l'organisme. Son apport est discontinu (au cours repas) mais sa concentration sanguine, ou glycémie (2), est maintenue constante autour de 1 g/L (de 0,75 à 1,05 g/L à jeun, jusqu'à 1,8 g/L après un repas). En effet un mécanisme de régulation fait intervenir notamment une hormone pancréatique, l'insuline (3), qui permet le passage du glucose du sang vers l'intérieur les cellules qui l'utilisent et/ou qui le stockent.
Il y a diabète quand il y a hyperglycémie chronique, soit une glycémie à jeun supérieure à 1,26 g/L (4)
Question : l'appareil de l'image Mesure de la glycémie affiche-t-il une glycémie normale ? .
Images : 1 Traitement Rastop - 2 SVT 1S, Belin 2005, p. 250 - 3 SVT 1S, Bordas 2001, p. 148 - 4 www.futura-sciences.com

1. L’insulinorésistance. Un excès de graisse musculaire et viscérale entraîne une augmentation de la quantité d'acides gras circulants conduit d'une part à leur utilisation préférentielle par les cellules musculaires qui n'utilisent plus d'insuline pour absorber le glucose sanguin et, d'autre part, à leur transformation en glucose par les cellules hépatiques (= du foie). Ces deux mécanismes concourentà augmenter la glycémie.
2. L'hyperinsulinisme. En réponse à l'excès de glucose sanguin le pancréas augmente fortement sa production d'insuline. Cela permet de pallier l'insulinorésistance et de conserver une glycémie pratiquement normale.
3. L’insulinodéficience. Après 10 à 20 ans d'hyperinsulinisme les cellules du pancréas s'épuisent et ne parviennent plus à sécréter suffisamment d'insuline pour maintenir une glycémie normale. Le diabète de type 2 s'installe.
Références : www.inserm.fr et www.medecine.ups-tlse.fr
- Contrairement au diabète de type 2, le diabète de type 1, qui touche les jeunes vers l'âge de 12 ans, est dû uniquement à une insuffisance de la production d'insuline.

Ces signes n’apparaissent qu’à un stade déjà avancé de la maladie. Envie fréquente d'uriner (liée à une perte urinaire de glucose) - Soif excessive - Faim exagérée - Fatigue et somnolence - Vision trouble - Engourdissement ou picotements des mains ou des pieds - Perte de poids - Cicatrisation lente.
Image (modifiée) : www.mieuxvivrelediabete.com

Une neuropathie est une affection des nerfs moteurs et sensitifs des muscles squelettiques et des nerfs qui commandent les organes. Dans le cas du diabète elle se manifeste notamment par une perte de sensibilité au niveau des pieds avec risque de se blesser sans s'en rendre compte ainsi que par des troubles de la régulation nerveuse de la fréquence cardiaque (voir cours de seconde chapitre 3.2) et parfois par des troubles digestifs (diarrhées) ou uro-génitaux.
Image : www.lediabete.net

Dans une artère saine le sang circule librement (A). L'excès de cholestérol sanguin et l'hypertension (voir cours de seconde chapitres 3.1 et 3.2) peuvent entraîner la formation de plaques d'athérome (B), c'est l'athérosclérose. La réduction du diamètre artériel provoque une baisse du débit sanguin et donc une baisse de l'oxygénétion de l'organe irrigué. Enfin, il peut se former un caillot sanguin (C) qui obstrue totalement l'artère. Selon l'organe touché, il existe trois grandes manifestations de l'athérosclérose : l'accident vasculaire cérébral (AVC), l'insuffisance coronaire (artères du cœur), l'artérite des membres inférieurs. Le diabète est un facteur de risque qui aggrave ces pathologies.
Image : Hatier SVT 2de, 2010 p. 205

Une rétinopathie est une altération de la rétine pouvant entraîner une cécité. Dans le cas du diabète, elle se manifeste, entre autres, par de petites hémorragies (flèches) des capillaires sanguins qui irriguent la rétine (voir chapitre 3.4).
Image : umvf.univ-nantes.fr

Une néphropathie est une atteinte des reins. Dans les cas de diabète elle se manifeste d'abord par une augmentation de la taille des reins et de la production d'urine. Apparaît ensuite une protéinurie (albuminurie) pouvant conduire à une insuffisance rénale nécessitant des dialyses voire une greffe de rein.
Image : archipeldessciences.wordpress.com

Depuis 1985, le diabète suit un taux de croissance au rythme alarmant. En 2011, 366 millions de personnes sont atteintes de diabète dans le monde et leur nombre progresse rapidement, particulièrement dans les pays en développement. Il pourra dépasser les 550 millions d’ici 2030, soit un chiffre supérieur à la population actuelle de l'Amérique du Nord. Selon l'Organisation Mondiale de la Santé (OMS) le diabète est la première pandémie non infectieuse de l'humanité.
Source : www.idf.org et www.idf.org/diabetesatlas (diabètes de types 1 et 2)

L’augmentation de la prévalence a été estimée en moyenne à +6 % par an entre 2000 et 2009 avec un accroissement des disparités géographiques. Dans les années qui viennent, il est probable que la prévalence du diabète continue de progresser du fait :
- du vieillissement de la population générale (la fréquence du diabète est étroitement liée à l’âge) ;
- de l'allongement de l’espérance de vie des personnes diabétiques, liée à une meilleure qualité des soins relatifs au diabète et aux autres maladies (lien non démontré sur les données françaises) ;
- de l’augmentation de la fréquence de l’obésité, qui est un facteur de risque majeur.
Source : opac.invs.sante.fr Institut de veille sanitaire Novembre 2010
 2
2
1 Répartition géographique de la prévalence du diabète en France (malades traités en 2009) - Prévalence du diabète dans les pays de l'OCDE (cas probables en 2010)
On estime au minimum à 2 700 000 le nombre de diabétiques de type 2 diagnostiqués en France (soit près de 92 % des diabétiques) avec une prévalence plus élevée chez les hommes (6,4 %) que chez les femmes (4,5 %) à âge égal (1). Il convient cependant de rajouter à ce nombre 500 000 à 800 000 diabétiques qui s'ignorent, ce qui porte cette prévalence à 6,7 % (2). En effet le diabète de type 2 s'accompagne rarement de symptômes à ses débuts et on le découvre bien souvent tardivement.
Images : 1 opac.invs.sante.fr source Assurance maladie Régime général 2009 - 2 www.oecd.org (diabètes de types 1 et 2 en 2010, la définition du diabète varie d'un pays à l'autre).

- Un risque relatif supérieur à 1 caractérise une maladie familiale. Cela ne veut pas toujours dire maladie génétique. En effet, il peut exister des facteurs d'environnement familial (cas des maladies infectieuses par exemple).
- Le taux de concordance des vrais jumeaux (génétiquement identiques) est supérieur à celui des faux jumeaux (non génétiquement identiques). Les facteurs d'environnement familial étant de même nature pour les deux types de jumeaux, cela confirme la réalité d’une composante génétique dans la transmission de la maladie.
Sources : acces.ens-lyon.fr - medidacte.timone.univ-mrs.fr
Montrer que les données familiales ne sont pas conformes aux prévisions en supposant qu'un seul gène est en jeu dans le diabète de type 2. Envisager successivement le cas d'un phénotype récessif puis celui d'un phénotype dominant et appuyer le raisonnement sur des échiquiers de croisement. Correction

Le gène calpaïne 10 (CAPN-10) code une protéase (enzyme capable de digérer des protéines). Porté sur le bras long du chromosome 2, il est formé de 13 exons (en bleu sur l'image) et 15 introns. Il s'exprime, par épissage alternatif, en 8 protéines différentes. Dans une population de Mexicains-Américains, trois emplacements sont particulièrement polymorphes. Pour chacun, on note l'existence de deux allèles prédominants. En particulier chez les homozygotes GG, on note une baisse de la quantité d'ARNm de CAPN-10 dans les cellules musculaires squelettiques ainsi qu'un plus grand degré de résistance à l'insuline. De manière surprenante ce polymorphisme affecte des parties non traduites du gène (introns).
Source : www.snv.jussieu.fr
Sources : www.inserm.fr - acces.ens-lyon.fr - www.cnrs.fr - www.maxisciences.com

Les allèles de prédisposition au diabète mis en évidence sont majoritairement des allèles sauvages, ancestraux et très représentés dans la population. La théorie dite du "génotype d’épargne" postule que les gènes impliqués dans le diabète, l’obésité ou les maladies cardiovasculaires présentaient un avantage sélectif dans la situation où l’homme était très actif, où il se dépensait beaucoup physiquement sans avoir de nourriture à profusion, sinon une alimentation frugale. Avec le changement de mode de vie, les allèles stimulant l’appétit, favorisant la croissance et le stockage d’énergie plutôt que sa dépense, qui conféraient un avantage sélectif dans les temps immémoriaux, sont devenus nocifs aujourd’hui.*
Images : 1fr.wikipedia.org - 2 edwige.roland.pagesperso-orange.fr - 3 archives-lepost.huffingtonpost.fr - * www.inserm.fr

Il s'apparente au diabète de type 2 (dont il représente 2 à 5% des cas), mais survient de manière beaucoup plus précoce, à la fin de l'adolescence ou chez l'adulte jeune. Cinq gènes (autosomiques) sont concernés mais la mutation d'un seul gène suffit à déclencher la maladie dont le phénotype est dominant (probabilité de transmission = 1/2 si un seul des deux parents atteint). Les effets de la maladie dépendent de la nature du gène muté.
Image : www.jle.com/fr - Sources : www.snv.jussieu.fr et www.chups.jussieu.fr

L'IMC permet d'évaluer les risques liés au poids chez l’adulte de 18 à 65 ans en définissant des intervalles standards. L’IMC n’est qu’un indicateur et non une donnée absolue. L'IMC de bonne forme varie en effet selon la morphologie de la personne et son activité physique (pour l'IMC des jeunes, voir cours de seconde chapitre 3.1).
Source : fr.wikipedia.org

Au Canada, en 2011 (image ci-contre), la moitié des non diabétiques sont en surpoids ou obèses (IMC médian 25 kg/m2) alors que moitié des diabétiques sont en fort surpoids ou obèses (IMC médian 29 kg/m2). Ainsi, plus des 3/4 des diabétiques présentent un excès pondéral*. En France, en 2009, la prévalence du diabète diagnostiqué était respectivement 2,5 fois et 3 fois plus élevée chez les hommes et les femmes en surpoids, et 5,5 à 6 fois plus élevée chez les hommes et les femmes obèses par rapport aux personnes de corpulence normale**.
*Image : www.phac-aspc.gc.ca Agence de la santé publique du Canada, 2011 - ** Source : opac.invs.sante.fr Institut de veille sanitaire 2010.

Être en surpoids ou obèse a des conséquences sur la santé, mais l’obésité abdominale a des effets encore plus graves. En effet, partout dans le monde, on observe une augmentation significative du diabète corrélée avec une augmentation du tour de taille et cela quel que soit l'IMC (il en est de même pour les maladies cardiovasculaires)* .
Il faut ici se souvenir que c'est la graisse viscérale qui entraîne l'excès d'acides gras circulants provoquant l'insulinorésistance lors du développement du diabète de type 2.
Source et image (modifiée) : www.inserm.fr - Rapport d'activité INSERM 2007, p. 32 - Étude IDEA sur 69 409 hommes et 98 750 femmes, âgés de 18 à 80 ans dans 63 pays (2007)

En France, de 2000 à 2009, le taux de sujets ayant un tour de taille nécessitant une perte de poids (102 cm pour l’homme et 88 cm pour la femme) atteint 11,8% chez le 18-24 ans (augmentation relative de + 43,9% depuis 2006) et 17,8% chez les 25-34 ans (augmentation relative de +29,2% depuis 2006). Le même phénomène s'observe dans tous les pays du monde. On considère qu'un tour de taille supérieur à 80 cm pour une femme et 90 cm pour un homme est un facteur de risque pour diverses maladies, notamment le diabète de type 2.
Source : www.roche.fr

L'obésité androïde est localisée surtout dans la partie supérieure du corps. Cette localisation au niveau des viscères entraîne des complications comme le diabète de type 2 ou les maladies cardiovasculaires. L'obésité gynoïde, surtout localisée dans la partie inférieure du corps, a moins d'incidence sur ces pathologies, mais est un facteur de risque pour d'autres troubles (thromboses, cancer du sein...).
Image : d'après conf-de-nutrition.blogs.fr
 2
2 
1 Répartition de la population française en fonction de son niveau d'IMC (2009) - 2 Évolution de l'obésité en France
En 2009 (1), 31,9% des Français adultes de 18 ans et plus sont en surpoids (25 < IMC < 30 kg/m2) et 14,5% sont obèses (IMC > 30 kg/m2). Ces valeur sont en constante progression depuis 1997 (2).
Images : www.roche.fr
 2
2 
1 Aliments riches en lipides - 2 Aliment riche en glucides
Un régime riche en lipides (graisses saturées) et/ou en glucides (sucres rapides) entraîne à long terme un dysfonctionnement du métabolisme lipidique favorisant l'insulinorésistance des cellules musculaires (diminution de l’oxydation des acides gras et accumulation de lipides intramusculaires). Cependant l’insulinorésistance est un phénomène complexe qui n'est pas complètement connu.
Images :1 www.diabete-enfant.com - 2 fr.best-wallpaper.net - Référence : www.inserm.fr

Comme l’insuline, l’exercice musculaire facilite l'absorption du glucose par les cellules musculaires mais fait intervenir des mécanismes indépendants. Or, chez les diabétiques de type 2, si l'absorption musculaire du glucose stimulée par l’insuline est diminuée, ce n’est pas le cas de l'aborption musculaire du glucose stimulée par l’exercice physique qui reste normale. Cela explique les effets bénéfiques de l’activité physique régulière chez le diabétique de type 2 et le facteur le facteur aggravant que constitue la sédentarité*. Celle-ci, multiplie le risque de diabète par 2.
Image : SVT 1S, Nathan 2001 p. 173 - * Référence texte : www.inserm.fr p. 229 (2008)
Source : opac.invs.sante.fr Institut de veille sanitaire Novemmbre 2010
 2
2  3
3
1 Tour de taille en fonction de l'âge (France 2009) - 2 Évolution de l'obésité en fonction de l'âge (France 2009) - 3 Prévalence du diabète de type 2 en France, en fonction de l'âge
On constate que le tour de taille (1) et l'obésité (2) augmentent avec l'âge dans les deux sexes. Avec l'âge le sujet accumule plusieurs facteurs d’insulinorésistance ce qui explique que la prévalence du diabète augmente avec l'âge. Rare chez les jeunes, il touche environ 17% de la population entre 75 et 79 ans. De plus, le diabète de type 2, qui se déclare en général après l'âge de 40 ans, passe souvent inaperçu jusqu'au stade de l'insulinodéficience de sorte qu'il n'est souvent diagnostiqué que tardivement*.
Images : 1 et 2 www.roche.fr - 3 opac.invs.sante.fr - 2009

L'augmentation de la fréquence d l'obésité dans la population se manifeste dès le plus jeune âge. Il en résulte une augmentation de la prévalence du diabète de type 2 chez les sujets jeunes et même chez les enfants.
Image : SVT 1S, Nathan 2011 p. 325
La répartition topographique du tissus adipeux et la variation typologique du tissu musculaire dépendrait de facteurs hormonaux et environnementaux : le stress, l’alcool, le tabagisme, favorisent la topographie androïde des graisses alors que la sédentarité et le vieillissement entraînent une élévation des fibres musculaires de type 2 par rapport aux fibres musculaires de type 1.
Source : www.chups.jussieu.fr
● Le diabète est considéré comme la première pandémie non infectieuse de l'humanité. Il s'agit d'une hyperglycémie chronique (glycémie à jeun > 1,26 g/L) qui, dans le cas du diabète de type II, est due à un épuisement du pancréas, celui-ci ne parvenant plus à produire suffisamment d'insuline. Il en résulte un ensemble de graves complications qui affectent notamment les yeux, les pieds et le reins.
● L'étude épidémiologique permet d'établir que les causes du diabète de type II reposent sur deux composantes indissociables.
-
Une composante génétique
À diverses reprises on a pu relier la présence d'un allèle particulier avec le développement d'un diabète. Cependant, la présence de cet allèle n'est ni nécessaire (il y a des diabétiques qui ne le possèdent pas) ni suffisante (il y a des individus sains qui le possèdent). Il existe donc des gènes qui rendent plus probable le développement de la maladie, sans pour autant le rendre certain. Il n'y a pas un gène du diabète, mais des gènes de susceptibilité, ou gènes de prédisposition. Cela explique que des antécédents familiaux de diabète augmentent le risque de survenue de la maladie sans qu'il soit possible de l'évaluer autrement que par une méthode statistique.
-
Une composante environnementale
La prévalence du diabète de type II augmente parallèlement à la sédentarité, à une alimentation hypercalorique (trop riche en glucides et en lipides), à l'obésité qui en résulte (surtout quand il s'agit d'une obésité androïde) et au vieillissement. Il s'agit d'une simple corrélation statistique car l'obésité ne conduit pas forcément au diabète.

1 poumon droit - 2 tumeur cancéreuse du poumon gauche - 3 rate - 4 rein gauche - 5 aile iliaque - 6 tête fémorale - Flèches = métastases hépatiques du cancer du poumon.
Un cancer est une tumeur maligne, c'est à dire formée d'une excroissance de tissu dédifférencié, à développement rapide et aux contours mal définis (2). En se développant, elle peut bloquer le fonctionnement de l'organe touché et essaimer dans d'autres organes en y formant de nouvelles tumeurs ou métastases (flèches).
Image : www.info-radiologie.ch

Les cancers sont des maladies décrites depuis l'Antiquité. Le médecin grec Hippocrate (460 à 370 av. J.-C ) a comparé les tumeurs cancéreuses à un crabe et leur a donné pour la première fois les noms grecs de « karkinos » et « karkinoma ». La comparaison est justifiée par l'aspect de certaines tumeurs, dont les prolongements rappellent les pattes de l'animal.
Image : www.ligue-cancer.net

Sur le plan phénotypique, une cellule cancéreuse perd ses caractères de différenciation, sa taille augmente, son noyau volumineux contient une chromartine irrégulièrement répartie (flèche en A). Elle se multiplie très rapidement mais ses mitoses présentent des anomalies de forme (flèches B), par exemple des fuseaux asymétriques (tripolaires).
Images : A www.chups.jussieu.fr - B coo.erasmusmc.nl (carcinome cervical humain)

Sans irrigation sanguine, la tumeur ne pourrait pas grossir au-delà d'un dixième de millimètre car les cellules cancéreuses ont besoin de nutriments et de dioxygène pour se multiplier. En réponse à leur besoin de dioxygène, elles produisent des signaux moléculaires (A) qui provoquent la formation de nouveaux vaisseaux sanguins (angiogenèse ou néovascularisation). Cela permet à la tumeur de poursuivre sa croissance (B). Certaines cellules peuvent alors se détacher de la tumeur, envahir les tissus voisins, atteindre les vaisseaux sanguins (C) ou lymphatiques, ce qui leur permet de coloniser un nouvel organe où elle formeront une métastase.
Image : www-dsv.cea.fr et www.ipmc.cnrs.fr voir aussi gfme.free.fr

Une cellule normale, ici un globule blanc (A), vieillit et meurt, après un certain nombre de divisions ou en réponse à des signaux internes divers. C'est l'apoptose ou mort cellulaire programmée au cours de laquelle la cellule se fragmente en corps apoptotiques (B) qui sont ensuite absorbés par des cellules phagocytaires (C) sans réaction inflammatoire. Parmi les signaux susceptibles de provoquer l'apoptose on trouve les mutations non réparées (voir chapitre 1.2).
Image : d'après www.lepoint.fr Dr. Gopal Murti/Visuals Unlimited/Corbis et www.ufrsdv.u-bordeaux2.fr

Grâce à la mitose (voir chapitre 1.1), les cellules qui meurent par apoptose, sont remplacées au fur et à mesure par de nouvelles cellules de structure et de fonction identiques (reproduction conforme). Chez l'adulte, cet équilibre maintient un nombre de cellules à peu près constant.
Images : www.snv.jussieu.fr

À la différence des cellules normales (A) pour lesquelles les mitoses permettent de renouveler les cellules qui ont subi une apoptose, les cellules mutantes peuvent avoir des destinées diverses. Généralement (B), soit la mutation (M1) est réparée (R) soit la cellule est immédiatement détruite par apoptose et n'entame pas le cycle cellulaire qui suit sa mutation (M2). Parfois elle survit (M3), et donne naissance à un clone cellulaire (C) qui se comporte comme les cellules normales. Si, à la suite d'une mutation (M4), une cellule perd ses capacités d'apoptose, elle devient immortelle et donne naissance à un clone cellulaire (D) qui se multiplie rapidement et indéfiniment. Au fil des cycles cellulaires, ces cellules accumulent de nouvelles mutations (M5, M6... voir ci-dessous) et deviennent des cellules cancéreuses (E) , on parle alors de tumeur maligne. Certaines de ces cellules peuvent alors se détacher de la tumeur (F), coloniser un nouvel organe et donner naissance à des métastases.

Une mutation peut atteindre et modifier la structure d'un gène spécifiant un facteur qui règle le contrôle de la multiplication cellulaire. La cellule mutante peut alors acquérir un avantage sélectif qui lui permettra des se multiplier davantage que les autres et de donner naissance à un premier clone de cellules anormales (lésion précancéreuse) où la probabilité qu'une seconde mutation apparaisse et soit sélectionnée augmente. Dans ce cas, une seconde population sera générée, plus anormale que la première et ainsi de suite. Une cellule cancéreuse résulte d'un processus clonal multiétapes, ces étapes étant des mutations génétiques.
Image : d'après fr.wikipedia.org

- Les proto-oncogènes dont l'activité stimule les divisions cellulaires (A). On les appelle oncogènes, lorsqu'à la suite d'une mutation, ils deviennent hyperactifs et stimulent anormalement la prolifération cellulaire (C). L’altération d’un allèle est suffisante pour entraîner une activation anormale.
- Les gènes suppresseurs de tumeurs (ou anti-oncogènes) capables d'inhiber les divisions cellulaires (A) et même de provoquer une apoptose (B). Leur action peut être inactivé à la suite d'une mutation (D).
- L'expression de ces gènes est normalement soumise à un équilibre entre facteurs activateurs et inhibiteurs de la division cellulaire (A), c'est l'homéostasie cellulaire. Toute altération de cet équilibre peut faire pencher la balance soit du côté inhibiteur (B), dans ce cas la cellule meurt et disparaît, soit du côté activateur (C ou D), dans ce cas la cellule se divise de façon incontrôlée et peut donner naissance à un cancer.

Une copie supplémentaire du gène p53 est introduite par transgénèse dans le génome d'un lot de souris. On teste ensuite la sensibilité de ces souris super p53 à une substance connue pour augmenter la survenue de cancers.
Source : SVT 1S, Belin 2011, p 266

Lors du cycle cellulaire (voir chapitre 1.1), il existe des points de contrôle qui ne sont franchis que si la cellule n'a pas subi d'altération de son matériel génétique. Si le point de contôle n'est pas franchi, des mécanismes de réparation se déclenchent. Lorsque la réparation est réussie, le cycle cellulaire se poursuit, dans le cas contraire, la cellule subit une apoptose. La protéine p53 intervient au point de contrôle situé entre les phases G1 et S de sorte que seul de l'ADN normal peut être répliqué.

La protéine p53 (393 acides aminés) est codée par le gène porté par le chromosome 17. C'est est un facteur de transcription capable de se fixer sur l'ADN lésé puis de provoquer la transcription de gènes qui codent des molécules permettant la réparation de l'ADN lésé. En cas d'échec, p53 provoque une apoptose.
Référence : www.librairiedemolecules.education.fr
 2
2 
1 Un exemple de mutation du gène p53 - 2 Les mutations du gène p53 (tous cancers confondus)
Le gène p53 est situé sur le chromosome 17 et compte 393 triplets dont la plupart peuvent muter (1361 mutations connues dont 112 en position 248). Ces mutations sont impliquées dans plus de 50% des cancers humains. Elles affectent des points chauds situés dans une zone qui altère le domaine liant la protéine p53 à l'ADN, ce qui entraîne son inactivation. L'équilibre de l'expression des oncogènes et des gènes suppresseurs de tumeurs est alors rompu. La cellule peut franchir le point de contrôle G1/S et poursuivre son cycle cellulaire, quelles que soient les altérations de son information génétique. C'est cet avantage sélectif qui lui permet d'accumuler des mutations pouvant la conduire à devenir une cellule cancéreuse.
Images : 1 traitement Anagène - 2 (modifiée) et source : p53.free.fr médecine/sciences 2000 - dossier.univ-st-etienne.fr - acces.ens-lyon.fr - acces.ens-lyon.fr
D’après Biologie moléculaire de la cellule, H. Lodish, De Boeck, 2000 - Médecine Sciences – n° 3 mars 2006

Les cellules cancéreuses décident de migrer vers le foie. Avant le départ, la plus ancienne cellule raconte l'histoire des gènes et oncogènes à ses consœurs.
www.inserm.fr - Production : La Sept/Inserm/CPI 1990
On observe ici une opacité ovale dans le poumon gauche. Le tabac est responsable de près de 90% des décès dus au cancer du poumon. Sa fumée contient en effet plus de 60 substances cancérigènes (= cancérogènes).
Image : fr.wikipedia.org - Données générales www.e-cancer.fr

On observe une baisse récente de la mortalité par cancer bronchique dans la population masculine (maximum en 1993), conséquence de l’importante réduction du tabagisme masculin en France, et un accroissement très important du risque de décès par cancer du poumon chez les femmes qui sont entrées dans le tabagisme beaucoup plus récemment. C’est pour la classe d’âge des 35 à 44 ans que les variations sont les plus spectaculaires : la mortalité chez les hommes a été divisée par deux en 10 ans et la mortalité chez les femmes a été multipliée par quatre en 15 ans. Le cancer du poumon est la conséquence la plus spécifique du tabagisme, mais le tabac augmente aussi considérablement le risque d’autres maladies respiratoires et de maladies cardiovasculaires, notamment d’infarctus du myocarde.
* Il s’agit de la consommation moyenne de la population, et non de la consommation moyenne des fumeurs.
Image (modifiée) : Institut de veille sanitaire www.invs.sante.fr

Cette étude épidémiologique , menée sur des non-fumeurs ayant un conjoint fumeur, montre que le tabagisme passif a des effets comparables à ceux du tabagisme actif.
Image : SVT, Bordas 2011 p. 288
 2
2 3
3 4
4 
1 Un composé de la fumée du tabac : le bezopyrène
2 Proportion de guanines modifiées sur des cultures de cellules après 24 heures d'exposition à différentes doses de benzopyrène
3 Mutation par altération chimique d'une base azotée
4 Pourcentages de souris présentant une tumeur après 4 mois d'exposition en fonction de la dose de benzopyrène
Le benzopyrène ((hydrocarbure aromatique polycyclique en 1A) est un produit de combustion incomplète des molécules organiques à des températures entre 300°C et 600°C. Il est notamment présent dans la fumée de cigarette puis absorbé par les cellules pulmonaires où il est transformé en BPDE (benzopyrène-diol-époxyde). Ce dernier est un composé très réactif qui peut se lier à la guanine de l'ADN (1B et 2). La guanine ainsi modifiée (désamination 1B) s'apparie alors avec l'adénine et non avec la cytosine (3). Il en résulte une mutation (transitions GC -> AT) au cycle cellulaire suivant (voir chapitre 1.2). Quand cette mutation affecte le gène p53, elle facilite l'apparition de tumeurs (4).
Sources : www.nature.com et croisscancer.pagesperso-orange.fr - Images 2 et 4 : SVT 1S, Belin 2011 p. 269
 2
2 3
3 
1 Prix et consommation du tabac en France - 2 Interdiction de fumer dans les lieux à usage collectifs - 3 Images choc sur les paquets de cigarettes
La politique publique active contre l'usage du tabac se traduit principalement par l’augmentation du prix du tabac (1), sa restriction d’accès aux mineurs de moins de 16 ans (2003), l’interdiction de fumer (2) dans les lieux à usage collectif (2006) et par des images choc (3) sur les paquets de cigarettes (2011). À 17 ans, l’usage quotidien du tabac concernait 41,1% des jeunes interrogés en 2000 et 28,9% en 2008, révélant une diminution de 27%. À 15 et 16 ans, la prévalence du tabac quotidien est passée de 31% en 1999 à 17% en 2007, soit une diminution de 45%.
Images : 1 (modifiée) www.invs.sante.fr - 2 www.francesoir.fr - 3 www.communes.com - Source : www.invs.sante.fr
Les produits cancérogènes peuvent provoquer un cancer, le produits mutagènes peuvent affecter la personne exposée ou sa descendance, les produits toxiques pour la reproduction peuvent avoir des effets néfastes sur la fonction sexuelle, diminuer la fertilité ou provoquer la mort du fœtus ou des malformations chez l'enfant à naître.
Les produits CMR sont classés selon leur niveau de dangerosité avéré (catégorie 1), très probable (catégorie 2), ou possible (catégorie 3).
Source : bip.cnrs-mrs.fr
Les mélanocytes sont des cellules de la base de l'épiderme qui fabriquent de la mélanine responsable de la pigmentation de la peau. Lorsqu'ils se multiplient est se regroupent, ils peuvent former un grain de beauté qui est bénin ou un mélanome qui est une tumeur maligne. Un mélanome représente une minorité des cancers de la peau, mais c’est le plus grave d’entre eux. Dans 80 % des cas, il se manifeste par l’apparition d’une tache pigmentée sur la peau et, dans 20 % des cas, par la modification de couleur et de forme d’un grain de beauté préexistant.
Image : www.cnrs.fr

Un mélanome se développe d’abord en surface (A). Avec le temps, et si aucun traitement n'est effectué, la tumeur progresse en profondeur à travers le derme et l'hypoderme (B). Il peut alors disséminer des cellules malignes par voie sanguine (C) et donner naissance à des métastases qui représentent un grave danger.
Image : www.utc.fr - Données générales www.e-cancer.fr

A comme Asymétrie. Forme ni ronde ni ovale et reliefs inégalement répartis.
B comme Bords irréguliers. Bords déchiquetés et mal délimités.
C comme Couleur non homogène. Présence désordonnée de plusieurs couleurs.
D comme Diamètre - Diamètre en augmentation. Diamètre supérieurà 6 mm.
E comme Evolution. Changement rapide de taille, de forme, de couleur ou d'épaisseur.
Images : fr.wikipedia.org www.wlz.be www.daviddarling.info - Source : www.e-cancer.fr

L'exposition au rayonnement ultraviolet (UV) (lien externe) est le principal risque environnemental des cancers de la peau. Les UV sont d'origine solaire ou artificielle (cabines de bronzage). Ils sont invisibles à l’œil humain et ne procurent aucune sensation de chaleur, on y est donc exposé sans s’en rendre compte. Selon la latitude, la saison, l’heure et la couverture nuageuse le rayonnement UV est composé à 95 à 99% d'UVA (longueur d'onde 315 à 400 nm) qui pénètrent profondément dans la peau en accélérant son vieillissement et de 1 à 5 % d'UVB (280 à 315 nm) qui stimulent la production de mélanine (bronzage) ou provoquent des coups de soleil.
Image : www.topnote.fr - Source www.e-cancer.fr

Les UV sont absorbées par certaines bases azotés (thymine et cytosine) quand elles sont répétées (1). Deux thymines (ou deux cytosines) consécutives sur le même brin d'ADN peuvent alors s'associer par liaison "forte" pour former un dimère (2). Cela déforme l'ADN (voir chapitre 1.2) et perturbe l'activité de l'ADN polymérase lors de la réplication de l'ADN. Il en résulte des mutations, des réarrangements chromosomiques voire un blocage de la division cellulaire.

Lors d'expositions intenses et/ou répétées aux UV (UVA et UVB) les mécanismes de réparation de l'ADN peuvent être saturés et des mutations peuvent affecter des gènes intervenant dans la cancérogénèse comme le gène p53. Pour cette raison le Soleil est classé cancérogène pour l'Homme par le CIRC.
Image : phareouest.fond-ecran-image.com - Sources : p53.free.fr et www.erudit.org

Dans les pays occidentaux, la fréquence des mélanomes est multipliée par deux tous les dix ans depuis 50 ans. Cette très forte augmentation a conduit à la mise en place d'importantes campagnes de prévention
Image : www.e-cancer.fr

L'indice universel de rayonnement UV est une valeur représentant l'intensité du rayonnement ultraviolet solaire en fonction du risque qu'il représente pour la santé.
Image : www.e-cancer.fr d'après OMS (2002)

Le phototype définit le type de peau. Or, certaines peaux sont plus sensibles que d’autres aux rayons UV. Les personnes de phototype I et II ont un risque plus élevé de mélanome.
Source et images : www.e-cancer.fr

Le mélanome se développe principalement chez les personnes à peau claire qui s'exposent de façon irrégulière (au cours des vacances) et sujettes à des coups de soleil. Ainsi, les risques de développer un mélanome sont plus élevés chez les personnes ayant reçu beaucoup de coups de soleils ou faisant des UV. L’âge à lequel on a attrapé des coups de soleil semble jouer un rôle important. En effet, les coups de soleil dans l’enfance sont associés au développement de grains de beauté qui sont des facteurs à risque dans le développement de mélanome.
Image (modifiée) : www.e-cancer.fr
A colonne vertébrale - 2 rectum - 3 vessie - 4 symphyse pubienne - 5 utérus - Flèches tumeur du col de l'utérus
Le cancer du col utérin est un cancer qui se développe à partir de l'épithélium du col de l'utérus.
Image (modifiée) : www.docteur-benchimol.com - Données générales www.e-cancer.fr

Un virus est une particule microscopique infectieuse formée d'une coque protéique (ou capside) parfois entourée d'une enveloppe de protéines. Il contient un acide nucléique (ADN ou ARN) et ne peut se multiplier qu'en pénétrant dans une cellule hôte puis en utilisant sa machinerie cellulaire. C'est un parasite intracellulaire obligatoire.
Image : fr.wikipedia.org

Il existe environ 140 génotypes connus de papillomavirus. Ils se transmettent par voie cutanée (par contact avec la peau). Si la plupart ne provoquent que de simples verrues, plusieurs types affectent les organes génitaux. On distingue alors les HPV bas risque, qui n'entraînent que des tumeurs bénignes, comme les types 6 et 11 qui sont liés à environ 90 % des verrues génitales et les HPV haut risque qui sont impliqués dans plus de 90 % des tumeurs malignes du col de l'utérus. C'est le cas du type 16 qui est le plus fréquemment rencontré et du type 18 le plus virulent.
Image : www.gebaermutterhalskrebs.ch - Sources : www.pasteur.fr - www.pasteur.fr/2
 2
2 
1 Incidence de l'infection à HPV et du cancer du col utérin en France - 2 Une maladie à évolution lente
Au cours de leur vie, environ 80% des femmes rencontrent un HPV qui se transmet dès le début de la vie sexuelle. La plupart des infections ont lieu avant l’âge de 25 ans (1, 2A), souvent à l'occasion des premiers rapports sexuels (même de simples jeux sexuels). Dans les semaines qui suivent l'infection le virus se réplique (2B). Les personnes infectées sont contagieuses mais elles ne le savent pas car, le plus souvent, l’infection génitale ne génère aucun symptôme. Dans 90 % des cas le système immunitaire élimine le virus en un à deux ans et la guérison est spontanée (2B). Si le système imminitaire n'élimine pas le virus, l’infection persiste et peut évoluer en cancer du col utérin (1, 2) qui met en moyenne une quinzaine d’années à se développer (1 : décalage entre les deux courbes).
Images : 1 www.esculape.com (cancer du col année 2005) et www.invs.sante.fr (sur 960 femmes en 2009) - 2 www.pasteur.fr (modifiée) et www.ncbi.nlm.nih.gov (modifiée)Comité Nobel de médecine et de physiologie 2008 - Illustration Annika Röhl
L'ADN viral (circulaire) des HPV s'intégre dans le génome de la cellule hôte qui reproduit alors les virus dont les protéines interfèrent avec les protéines de régulation du cycle cellulaire. Par exemple, la protéine E6 (151 acides aminés) des HPV 16 et 18 se lie à la protéine p53. Cela entraîne d'abord l'inactivation puis la destruction de la protéine p53 et participe à la dérégulation du cycle cellulaire ainsi qu'à la transformation tumorale. Il n'y a donc pas ici de mutation p53. Ce mécanisme ce cancérisation n'est pas le seul à intervenir. Par exemple, une autre protéine virale (E7) inactive une autre protéine participant à la régulation du cycle cellulaire pRb.
Source : www.123bio.net et www.inserm.fr (médecine/sciences 1996 ; 12)

Le préservatif protège contre de nombreuses IST. Mais les HPV peuvent se transmettre par simple contact au niveau des parties génitales. Le préservatif ne constitue donc pas une protection totalement efficace contre ces virus.
Image : fr.wikipedia.org

La cancérisation par HPV mettant une quinzaine d'années à se produire, cela laisse une fenêtre d’action importante pour détecter précocement les lésions précancéreuses et cancéreuses du col. Le frottis cervico-vaginal est un examen de dépistage précoce du cancer du col de l'utérus ou du vagin. Il permet de déceler la modification des cellules avant que celles-ci ne deviennent cancéreuses, permettant d'y opposer un traitement préventif. Quelques cellules sont prélevées puis observées au microscope. Par rapport aux cellules normales (A), les cellules pré-cancéreuses (B) se distinguent par leur forme arrondie et leur noyau anormalement développé.
Images : www.larousse.fr

Une vaccination est uniquement préventive et doit intervenir avant tout contact avec l'agent infectieux. La population ciblée par la vaccination se compose :
- des jeunes filles de 14 ans avant l'exposition au risque d'infection HPV ;
- des jeunes filles et jeunes femmes de 15 à 23 ans qui n'auraient pas eu de rapports sexuels ou, au plus tard, dans l'année suivant le début de la vie sexuelle.
Image : www.ladepeche.fr

L'un est divalent, dirigé contre les sérotypes 16 et 18 responsables de nombreux cancers, l'autre est est tétravalent, dirigé contre les sérotypes 6,11, 16 et 18, il agit aussi contre les HPV responsables de pathologies bénignes. Aucun vaccin ne protège contre tous les cancer du col. Les vaccins doivent donc être considérés comme permettant de réduire le risque de développement d'un cancer du col et non comme un vaccin anti-cancer du col.
Pour l'intérêt des deux vaccins voir : acces.ens-lyon.fr - Pour des données médicales à jour consulter www.afssaps.fr : vaccin papillomavirus
Le dépistage reste indispensable du fait de la protection partielle de la vaccination anti-HPV. Il repose sur un frottis cervico-utérin pratiqué tous les trois ans chez les femmes de 25 à 65 ans (après deux premiers frottis normaux pratiqué à un an d'intervalle). À partir de 25 ans, toutes les jeunes femmes, qu'elles soient ou non vaccinées, doivent bénéficier du dépistage par frottis.
Image : www.e-cancer.fr

La diminution de l'incidence du cancer du col de l'utérus est liée au développement du dépistage individuel. De plus c'est est un cancer de très bon pronostic lorsqu’il est détecté et traité à un stade précoce car taux de survie relative à 5 ans de 91,5 %. D ’où la nécessité d’une détection précoce.
Image : www.e-cancer.fr
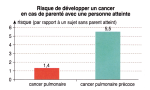
Étude épidémiologique menée au Texas de 1995 à 2003 sur deux groupes de personnes n'ayant jamais fumé : 316 personnes ayant développé un cancer pulmonaire et 318 sujets n'ayant pas dévelopé de cancer. Les cas de cancer parmi leurs parents proches (ascendants, fratrie, enfants) ont été relevés pendant toute la période de suivi. On évalue alors le risque statistique de développer un cancer si un parent proche est atteint.
Image : SVT, Bordas 2011 p. 288 - d'après Gorlova, 2007
Source : college-genetique.igh.cnrs.fr
 Devenir des cellules somatiques mutantes
Devenir des cellules somatiques mutantes
● Des modifications accidentelles du génome peuvent se produire dans des cellules somatiques et se transmettre à leurs descendantes. Elles sont à l’origine de la formation d’un clone cellulaire porteur de ce génome modifié. C'est parfois le commencement d’un processus de cancérisation qui est donc une maladie du génome.
● Une cellule cancéreuse a trois caractéristiques principales :
-
immortalité car elle ne répond plus ni aux systèmes de réparation de l'ADN ni aux signaux de destruction (apoptose) du fait d'une mutation de gènes suppresseurs de tumeurs (ou anti-oncogènes) qui les rend inactifs ;
- transformation car elle perd sa fonction initiale (elle se dédifférencie) à la suite d'une accumulation de mutations qui ne sont plus réparées (du fait de l'inactivité des gènes suppresseurs de tumeurs) ;
- prolifération rapide car le fonctionnement des gènes qui stimulent la multiplication cellulaire (proto-oncogènes mutés en oncogènes) l'emporte sur celui des gènes qui inhibent cette prolifération (gènes suppresseurs de tumeurs).
Il en résulte la formation d'une tumeur maligne, aux contours mal définis, rapidement vascularisée qui, en se développant, bloque le fonctionnement de l'organe touché et essaime dans d'autres organes en y formant de nouvelles tumeurs ou métastases.
● Des modifications somatiques du génome surviennent par mutations spontanées (fortuites, sporadiques) ou favorisées par une exposition répétée à un agent de l'environnement (ou agent mutagène) chimique (pesticides, solvants, fumée du tabac, alcool, alimentation...) ou physique (rayons UV, rayons ionisants...). Cela peut saturer les mécanismes de réparation d'ADN ou inactiver des gènes suppresseurs de tumeurs et déclencher un processus de cancérisation.
● D'autre modifications somatiques sont dues à des infections virales (ou bactériennes). L'agent infectieux ne provoque pas directement de mutation mais inactive l'effet de gènes suppresseurs de tumeurs.
● Des gènes de prédisposition affectant les cellules germinales augmentent la sensibilité aux agents de l'environnement. Ils rendent plus probable le développement de la maladie, sans pour autant le rendre certain. Inversement une personne ne présentant aucun facteur de risque peut développer un cancer.
● La connaissance de la nature des perturbations du génome responsables d’un cancer permet d’envisager des mesures de protection comme l'évitement des agents mutagènes, la surveillance permettant un dépistage précoce ou, parfois, la vaccination.
Les antibiotiques sont des molécules d'origine naturelle ou de synthèse à action spécifiquement antibactérienne (bactéricides ou bactériostatiques) et qui agissent à faible dose. Ils sont sans effet sur les virus ou les champignons. Les antibiotiques naturels sont fabriqués par des micro-organismes (champignons ou bactéries) et leur permettent d'éliminer les bactéries concurrentes avec lesquelles ils sont en compétition dans leur milieu (auréole d'inhibition autour de la colonie de Pénicillium).
Image : www.smccd.edu
 2
2 
1 Alexander Fleming - 2 Publicité pour la pénicilline (USA -1945)
Le premier antibiotique, la pénicilline, a été découvert en 1928 par Alexander Fleming (1) chez le champignon Penicillium notatum. La pénicilline a été ensuite produite industriellement à partir de 1944 et a rapidement permis de vaincre de graves infections. Les antibiotiques ont ainsi fait progresser l'espérance de vie de plus de 10 ans, soit plus qu'aucun autre médicament à tel point qu'ils ont rapidement été considérés comme des "médicaments miracles" (2). L'efficacité des antibiotiques a conduit à développer leur usage non thérapeutique (en médecine vétérinaire, comme additifs dans l'alimentation animale ou dans le traitement des maladies bactériennes des plantes).
Images : 1 en.wikipedia.org - 2 en.wikipedia.org
Un même antibiotique n'agit pas sur toutes les bactéries. Pour déterminer l'antibiotique le plus efficace contre un germe donné on réalise un antibiogramme. La bactérie est cultivée sur milieu gélosé dans un boîte de Pétri en présence de disques de buvard imprégnés d’antibiotiques*. Chaque antibiotique diffuse à partir du disque et sa concentration est d’autant plus faible que l’on s’éloigne du disque. Plus l'auréole d'inhibition est grande plus l'antibiotique est efficace. Pour un atibiotique donné une souche donnée est soit sensible S, résistante R ou intermédiaire I.
* ici IMP imipénème (S) - CF céfalotine (R) - TIC ticarciline (S) - GM gentamicine 500 (I) - FT nitrofurane-furane (R) - CS colistine (I)
Image : geniebio.ac-aix-marseille.fr Pascal Fraperie, Lycée Saint Louis, Bordeaux - Pour le codage des antibiotiques voir fr.wikipedia.org/wiki/Antibiogramme

Chaque famille d'antibiotiques se fixe sur une cible spécifique et bloque une étape essentielle du développement de la bactérie : synthèse de la paroi (A : pénicillines, céphalosporine), de la membrane cytoplasmique (B : polymixines), de l'ADN (C : quinolones), des protéines par les ribosomes (D : streptomycine, chloramphénicol, tétracyclines).
Source : La Recherche n° 314, novembre 1998
Les virus ne possèdent pas de métabolisme propre : pour se multiplier, ils détournent les outils de la cellule qu'ils colonisent. Ne présentant pas les cibles sur lesquelles les antibiotiques sont actifs, les virus leur échappent. Seuls les antiviraux permettent éventuellement d'en venir à bout.

* IMP imipénème - CF céfalotine - TIC ticarciline - GM gentamicine 500 - FT nitrofurane-furane - CS colistine
Pour être actif un antibiotique doit parvenir au contact de la bactérie, y pénétrer, ne pas être désactivé et se fixer sur sa cible. Si l'une de ces conditions n'est pas remplie, l'antibiotique se révèle inefficace, c'est le phénomène de résistance. On observe ici l'acquisition d'une résistance à la ticarciline (TIC) pour la souche B.
Images : geniebio.ac-aix-marseille.fr Pascal Fraperie, Lycée Saint Louis, Bordeaux - Pour le codage des antibiotiques fr.wikipedia.org/wiki/Antibiogramme
 2
2 
1 Séquences nucléotidiques et protéiques de deux variants de la bêta-lactamase - 2 Enzyme bêta-lactamase (en bleu) associée à la céfotaxime* (en rouge)
Les bêta-lactamases sont des protéines enzymatiques, naturellement présentes chez les bactéries, comme Escherichia coli qui est naturellement insesible à la pénicilline. Alors que les souches sauvages (bactéries SHV-1) sont sensibles aux antibiotiques de la famille des bêta-lactamides (exemple la céfotaxime qui agit en inhibant la synthèse de la paroi bactérienne) des souches dérivées (bactéries SHV-2) sont résistantes. Elles possèdent en effet une enzyme légèrement différente (1) qui leur permet de dégrader aussi ces antibiotiques (2).
* Remarquer sur 2, en dehors du site actif, un fragment provenant de la dégradation de la molécule d'antibiotique. Deux autres fragments sont ici masqués par la bêta-actamase.
Images : 1 Traitement Anagène - 2 Traitement RasTop

Les mutations sont des phénomènes rares, qui apparaîssent spontanément avec des fréquences de l'ordre de 10-6 à 10-9. Les antibiotiques ne sont pas mutagènes mais sélectionnent les rares mutants résistants (B) au sein d'une population (A) car ils détruisent ou inhibent uniquement les bactéries sensibles. Cette résistance confère un avantage sélectif à la souche mutante qui lui permet de se multiplier (C) en présence de l'antibiotique. Cela d'autant plus qu'elle est débarrassée de la compétition avec la souche sauvage.

L'information génétique d'une bactérie est portée par :
- un unique chromosome formé d'une molécule d'ADN chromosomique, en général circulaire, qui contient toute l'information génétique indispensable à la cellule ;
- un ou plusieurs plasmides qui sont des molécules d'ADN circulaires extra-chromosomiques, additionnelles et capables de réplication indépendante de l'ADN chromosomique. Les gènes qu'ils portent ne sont pas indispensables à la bactérie mais lui sont souvent avantageux, comme les gènes de résistance aux antibiotiques.
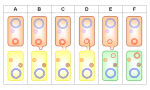
La conjugaison est le mécanisme de transfert de gène le plus fréquent. Une bactérie donneuse (A en rose) entre en contact (B, C) avec une bactérie receveuse (en jaune). Un seul des deux brins de l'ADN d'un plamide est tranféré (D) puis, après séparation (E), chaque cellule synthétise le brin complémentaire. Un gène de résistance peut ainsi être transféré entre bactéries, même si elles appartiennent à des espèces différentes, c'est une transmission horizontale.

Au cours de chaque transfert l'information génétique responsable de la résistance est dupliquée ce qui multiplie la prolifération résultant des divisions cellulaires. Une bactérie peut héberger plusieurs plasmides et il n'est pas rare qu'un même plasmide véhicule plusieurs gènes de résistance (jusquà 7). L'acquisition d'un tel plasmide par une bactérie lui permet d'être multirésistante en une seule étape.
Pour infos : www.cell.com

- A : en devenant imperméables à leur pénétration ou en les rejetant ;
- B : en modifiant leurs cibles ;
- C : en produisant des enzymes capables de les neutraliser (les enzymes sont des protéines qui ont pour fonction de catalyser une réaction chimique).
Source : La Recherche n° 314, novembre 1998

À partir de la date d'apparition de l'antibiotique, la durée d'efficacité est indiquée en bleu. Il suffit généralement de quatre ou cinq ans pour qu'apparaisse de souches résistantes. Une période d'efficacité diminuée (frontière bleu/vert) précède parfois l'apparition d'une vraie résistance (en vert).
Image : Pour la science n° 131 - mai 2005

Plus on utilise d'antibiotiques plus la proportion de souches résistantes augmente. En effet, l'administration répétée d'antibiotiques crée une pression de sélection qui favorise le succès des mutations et des échanges plasmidiques responsables de l’acquisition de résistances aux antibiotiques. Elle tend ainsi à éliminer les bactéries sensibles pour laisser place aux seuies bactéries résistantes.
* Consommation de fluoroquinolones dans les hôpitaux publics du Danemark et résistance d'Escherichia coli.
Source : www.onerba.org

Ces trois antibiotiques sont couramment utilisés en France, parfois sans prescription médicale et sans que leur utilisation soit toujours nécessaire. Cela entraîne une diminution de leur efficacité.
Image : SVT 1eS, Belin 2011, p. 274
 2
2
1 Résistance des pneumocoques résistants à la pénicilline en Europe (2005) - 2 Consommation d'antibiotiques en Europe
C'est en France que la résistance des pneumocoques est la plus élevée en 2005 avec un taux supérieur à 50% (1) alors qu’ils étaient largement sensibles à cet antibiotique 15 ans plus tôt. Cela est en relation avec la consommation d'antibiotiques. En Europe celle-ci peut être schématiquement divisée en trois zones (2) : les pays du Nord, faibles consommateurs d’antibiotiques, les pays de l’Est, consommateurs modérés et les pays du bassin méditerranéen, notamment la France, forts consommateurs. Toutefois, ces écarts tendent à se réduire, même s’ils demeurent importants. En France, la consommation totale d’antibiotiques a diminué de 16% au cours des dix dernières années mais on observe à nouveau une tendance à la hausse depuis 2005. Les efforts conjoints de vaccination et de réduction des consommations antibiotiques, notamment chez les enfants, ont permis une réduction constante, depuis 2003, de la proportion de pneumocoques résistants à la pénicilline pour atteindre 27 % en 2009.
Image 1 Pour la science n° 131 - mai 2005 - Sources : 2 www.ansm.sante.fr , texte www.invs.sante.fr
 2
2 
1 Campagnes d'information du public - 2 Résistance aux antibiotiques : comment lutter ?
Les antibioésistances ont conduit les autorités sanitaires à préconiser un usage plus raisonné des antibiotiques par des campagnes d'information (1) qui font connaître les règles du bon usage des antibiotiques (2).
Images : 1 Assurance maladie - 2 D'après une brochure ansm.sante.fr
● Les antibiotiques sont des molécules d'origine naturelle (produites par des bactéries ou des champignons) ou de synthèse, à action spécifiquement antibactérienne et qui agissent à faible dose. Leur découverte et leur utilisation ont permis de vaincre un grand nombre d'infections dans la seconde moitié du 20e siècle.
● Certaines bactéries possèdent des résistances naturelles aux antibiotiques (par exemple, les bactéries productrices d'antibiotiques sont insensibles aux substances qu'elles produisent). Cependant, des mutations spontanées et des mécanismes de transfert de gènes provoquent une variation génétique dans les populations de bactéries. Parmi ces variations, certaines font systématiquement apparaître des résistances acquises à un ou plusieurs antibiotiques (bactéries multirésistantes).
 Apparition d'une souche résistante à la suite d'une mutation
Apparition d'une souche résistante à la suite d'une mutation● L’application d’un antibiotique sur une population bactérienne détruit les souches sensibles mais opère une sélection naturelle des souches résistantes et permet leur multiplication dans un environnement dépourvu de concurrence. C'est un exemple d'évolution visible à l'échelle humaine. L'utilisation abusive des antibiotiques favorise le développement des souches résistantes ce rend inefficace l'utilisation du médicament et pose des problèmes de santé publique préoccupants.
● L’Homme aussi bien que les microorganismes infectieux susceptibles de l’attaquer présentent une forte variabilité génétique issue de mutations et conservée au cours des générations. Cette variabilité entraine des implications en matière de santé :
- les hommes ne sont pas « génétiquement égaux devant la maladie » ;
- l’évolution rapide des microorganismes pose des problèmes en termes de prévention et de traitement.
● Si, dans certains cas, une mutation génétique a un impact direct sur la santé (cas de la mucoviscidose), le plus souvent l'impact du génome sur la santé n'est pas un déterminisme absolu (cas du diabète de type II ou des cancers). Dans ce cas la mise en place d’un phénotype dépend de l’interaction complexe entre le génotype et l’histoire personnelle.
Pour en savoir plus
Sitographiewww.genet.sickkids.on.ca Base de données sur les mutations du gène CFTR (niveau universitaire)
fr.wikipedia.org Article Mucoviscidose
www.chups.jussieu.fr Le diabète
www.snv.jussieu.fr Le diabète de type II
www.allodocteurs.fr : Le diabète (vidéo)
www.roche.fr Enquête triennale ObÉpi Roche sur le surpoids et l'obésité
www.e-cancer.fr Institut national du cancer
www.e-cancer.fr la situation-du cancer en France 2010
www.snv.jussieu.fr La régulation du cycle cellulaire
www.snv.jussieu.fr Cancers et gènes suppresseurs de tumeurs
acces.ens-lyon.fr Le cancer du col de l'utérus et HPV
www.chups.jussieu.fr Biologie du cancer
Tout sur p53 p53.free.fr et p53.fr OU p53.iarc.fr
La Recherche n° 314, novembre 1998 : Les antibiotiques
1. On calcule la probabilité pour chacun des membres du couple d'être hétérozygote.
2. On calcule la probabilité pour que les membres du coule soient tous les deux hétérozygotes.
3. On multiplie cette dernière valeur par 1/4 qui est la probabilité pour un couple d'hétérozygotes d'avoir un enfant malade.
Couple II1-II2
II et II2 ont déjà un enfant malade, comme ils ne sont pas eux-mêmes malades ils sont tous les deux hétéozygotes Aa (voir cours).
La probabilité qu'ils aient un enfant malade est donc de 1/4 (voir cours).
Couple II6-II7
Ce sont deux individus de la population générale car ils ne connaissent aucun cas de mucoviscidose dans leurs familles.
La probabilité pour chacun d'être hétérozygote est donc de 1/35 (cf. cours).
La probabilité pour que II6-II7 soient tous les deux hétérozygotes est 1/35 x 1/35
Leur probabilité d'avoir un enfant malade est donc 1/35 x 1/35 x 1/4 = 1/4900 qui est la probabilité pour un couple quelconque d'avoir un enfant malade (cf. cours).
Couple II4-II5
II4 a un frère malade mais ne l'est pas lui même la probabilité pour qu'il soit hétérozygote est donc égale à 2/3 (voir cours) car il a forcément des parents hétérozygotes.
II5 ne ne connaît aucun cas de mucoviscidose dans sa famille. La probabilité pour qu'il soit hétérozygote est donc de 1/35 (cf. cours).
La probabilité pour que II4-II5 soient tous les deux hétérozygotes est 2/3 x 1/35.
Leur probabilité d'avoir un enfant malade est donc 2/3 x 1/35 x 1/4 = 1/210.
On peut aussi rechercher la probabilité pour que III1 ait un enfant malade avec un père ne se connaissant pas d'antécédent (réponse : 1/35 x 1/2 = 1/70).
Retour

Des parents diabétiques ont chacun pour génotype aa et ne produisent que des gamètes a. Ils ont donc 100% d'enfants aa diabétiques (voir le tableau de croisement). Or ce n'est pas le cas puisque le risque relatif observé n'est que de 50%.
Cas d'un phénotype diabétique [A] dominant (voir échiquiers)
Un individu diabétique a pour génotype AA ou Aa et un non diabétique est aa. Un couple Aa x aa aura 50% d'enfants malades (car Aa produit 50% de gamètes A) et un couple Aa x Aa aura 75% d'enfants malades (voir le tableau de croisement). Or, ce n'est pas le cas puisque les risques relatifs observés sont respectivement de 30% et 50%.
Conclusion
Aucun des modes de transmission d'une maladie monogénique n'est applicable au diabète de type 2.
Retour







